離子交換層析技術是以離子交換纖維素或以離子交換葡聚糖凝膠為固定相,以蛋白質等樣品為移動相,分離和提純蛋白質、核酸、酶、激素和多糖等的一項技術。 (一)原理
在纖維素與葡聚糖分子上結合有一定的離子基團,當結合陽離子基團時,可換出陰離子,則稱為陰離子交換劑。如二乙氨乙基(Dicthylaminoethyl,DEAE)纖維素。在纖維素上結合了DEAE,含有帶正電荷的陽離子纖維素—O—C6 H14N+
H,它的反離子為陰離子(如Cl-
等),可與帶負電荷的蛋白質陰離子進行交換。當結合陰離子基團時,可置換陽離子,稱為陽離子交換劑,如羧甲基(Carboxymethy, CM)纖維素。纖維素分子上帶有負電荷的陰離子(纖維素-O-CH2-COO
一
),其反離子為陽離子(如Na+
等),可與帶正電荷蛋白質陽離子進行交換。
溶液的pH值與蛋白質等電點相同時,靜電荷為0,當溶液pH值大于蛋白質等電點時,則羧基游離,蛋白質帶負電荷。反之,溶液的pH值小于蛋白質等電點時,則氨基電離,蛋白質帶正電荷。溶液的pH值距蛋白質等電點越遠,蛋白質的電荷越多。反之則越少。血清蛋白質均帶負電荷,但各種蛋白質帶負電荷的程度有所差異,以白蛋白為**多,依次為 球蛋白, 球蛋白和 球蛋白。
在適當的鹽濃度下,溶液的pH值高于等電點時,蛋白質被陰離子交換劑所吸附;當溶液的pH值低于等電點時,蛋白質被陽離子交換劑所吸附。由于各種蛋白質所帶的電荷不同。它們與交換劑的結合程度也不同,只要溶液pH值發生改變,就會直接影響到蛋白質與交換劑的吸附,從而可能把不同的蛋白質逐個分離開來。
交換劑對膠體離子(如蛋白質)和無機鹽離子(如NaCl)都具有交換吸附的能力,當兩者同時存在于一個層析過程中,則產生競爭性的交換吸附。當Cl一
的濃度大時,蛋白質不容易被吸附,吸附后也易于被洗脫,當Cl一
濃度小時,蛋白質易被吸附,吸附后也不容易被洗脫。因此,在離子交換層析中,一般采用兩種方法達到分離蛋白質的目的。一種是增加洗脫液的離子強度,一種是改變洗脫液的pH值。pH值增高時,抑制蛋白質陽離子化,隨之對陽離子交換劑的吸附力減弱。pH值降低時,抑制蛋白質陰離子化,隨之降低了蛋白質對陰離子交換劑的吸附。當使用陰離子交換劑時,增加鹽離子,則降低pH值。當使用陽離子交換劑時,增加鹽離子濃度,則升高溶液pH值。
(二)常用離子交換劑的種類與特性
1.離子交換纖維素 離子交換纖維素的種類很多,其種類與特性如表1-1所示。
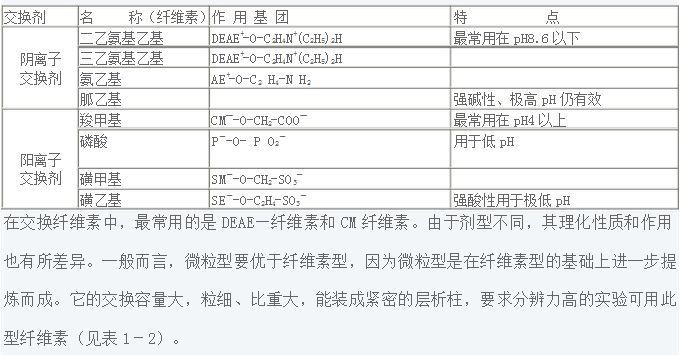
表1-1 離子交換劑的類型與特點
2.離子交換交聯葡聚糖 離子交換交聯葡聚糖也是廣泛使用的離子交換劑,它與離子交換纖維素不同點是載體不同,常用交聯葡聚糖的類型與特性見表1-3。
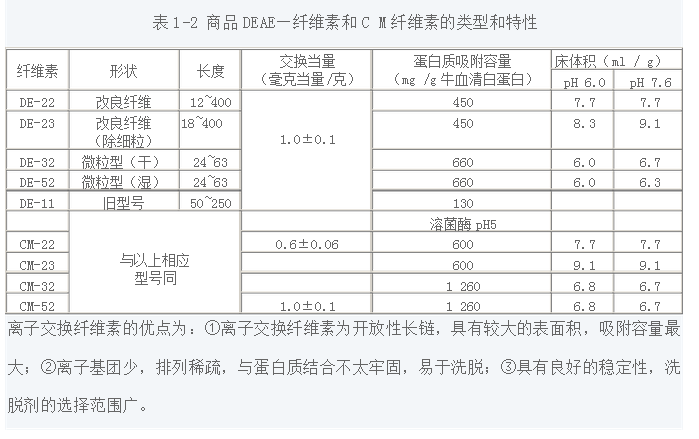
表1-3 常用交聯葡聚糖的類型與特性
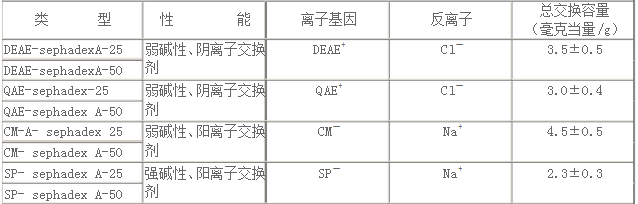
離子交換交聯葡聚糖有如下優點:①不會引起被分離物質的變性或失活;②非特異性吸附少;③交換容量大。
離子交換葡聚糖的選用,一般根據蛋白質的分子量而定。中等分子量(30 000-200 000)一般選A50和C50,而低分子量(<30 000和高分子量>200 000)均宜選用A25和C25。 (三)試驗方法
陰離子交換劑與陽離子交換劑的裝柱和層析過程基本相同。交聯葡聚糖的預處理只需充分溶脹和平衡,不需要除去細粒碎片和酸堿處理。其他步驟也基本同離子交換纖維素。 1.劑型的選擇 根據蛋白質在所用緩沖液pH值下帶電荷的種類選擇,如pH高于蛋白質等電點,應選陰離子交換劑,反之應選陽離子交換劑。一般情況下,DEAE-纖維素用于分離酸性蛋白,而CM纖維素用于分離堿性蛋白質。
下面以DEAE-纖維素操作為例,介紹試驗方法
2.膨脹活化 此步的目的在于除去雜質,暴露DEAE-纖維素上的極性基團。DEAE-纖維素的用量則根據柱容積的大小和所需過柱樣品的量來決定。一般是1.0g DEAE-纖維素相當于6ml~8ml柱床體積。
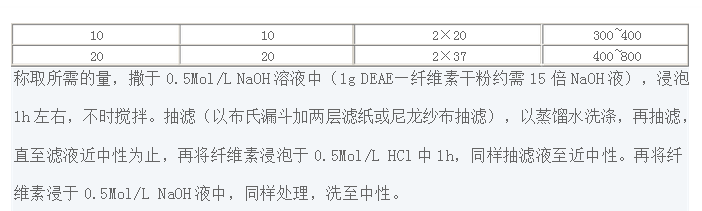
表1-4 分離的血清與所需DEAE—纖維素量及其他條件的大致關系

3.平衡 將DEAE—纖維素放入0.0lMol/L pH 7. 4 PB液中(即起始緩沖液),靜止1h,不時攪拌,待纖維素下沉后,傾去上清液或抽濾除去洗液,如此反復幾次**傾出液體的pH值與加入的PB液的pH值相近時為止。
4.裝柱 層析柱的選擇要大小、長度適當。一般而言,柱長和柱直徑之比為10︰1~20︰1,柱的內徑上下要均勻一致。用前將層析柱在清潔液內浸泡處理24h,然后依次用常水、蒸餾水、起始緩沖液充分洗滌。 #p#分頁標題#e#
裝柱時,先剪一塊圓形的尼龍紗布(直徑與層析柱內徑一致),放入層析柱底部。將柱下端連接細塑料管,夾上螺旋夾。把層析柱垂直固定在三角鐵架上,倒入起始緩沖液**一半的柱高,除去死區及塑料管內的氣泡。再將平衡的DEAE-纖維素糊狀物沿管壁倒入柱中。注意不要產生氣泡,如有氣泡應排除或重裝。擰開螺旋夾,使流速**1ml/5min,待緩沖液快接近纖維素面時,繼續倒入纖維素糊,同時用玻璃棒攪拌表面層,以免使兩次加入的纖維素形成分界層,通過進出緩沖液調節流量,也可通過塑料管的升降來控制,**柱床體積不變為止。剪一圓形濾紙(與柱內徑大小一致),從柱的上端輕輕放入,使其沉接于纖維素床表面,以免在加樣時打亂纖維素層。裝好柱的柱面應該是平整的,無傾斜,整個柱床內無氣泡、不分層。繼續平衡,使流出液的pH值與流入液的pH值完全一致為止。
5.上樣 要層析的樣品shou先必須用起始緩沖液(4℃)平衡過夜,中間可換液數次。將柱的上端打開,用吸管將纖維素柱上面的緩沖液吸出,不要吸凈,留一薄層液面,以免空氣進入。沿管壁緩緩加入樣品,注意不要打亂纖維素表層。擰開下端的螺旋夾,使樣品進入交換劑中,快要進完時,加1ml~2ml緩沖液沖洗柱壁,隨即用多量的洗脫液洗脫。 樣品的加量與DEAE—纖維素有一個**適比的關系,超過這個比值,吸附就不完全,直接影響到分離的純度。經過粗提的 —球蛋白50mg~100mg,用干重約4g DEAE-纖維素裝柱分離,可獲得理想結果。
6.洗脫 對于陰離子交換劑而言,洗脫的辦法是使pH逐漸降低,而離子濃度逐漸升高。一般的辦法,是穩定一個因素而改變另一個因素洗脫。洗脫可采用分段洗脫和連續洗脫法,前者較實用,后者較準確。
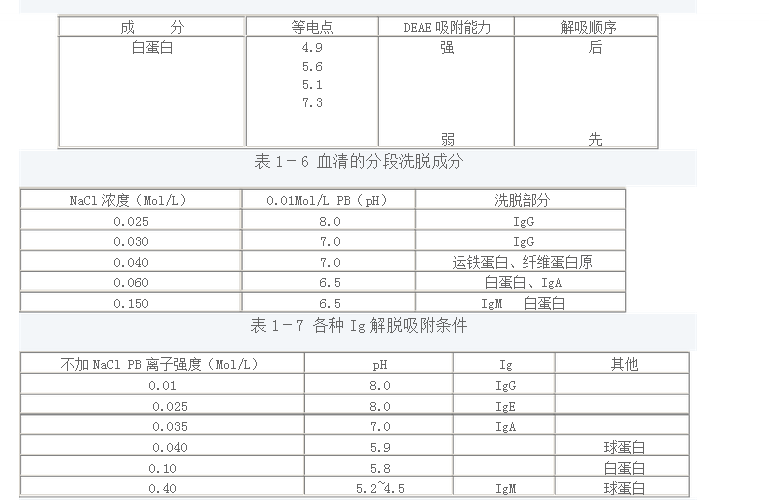
表1-5 血清蛋白各成分的吸附與解吸的關系
7.洗脫液的收集 利用自動分步收集器收集,并以20%磺基水楊酸測試,當蛋白液下來時,開始分管收集,**無蛋白液為止。
8.交換柱的再生 將使用過的DEAE-纖維素移入燒杯中,用2Mol/L NaCl液浸泡,抽濾并洗滌數次。如不立即使用,可加1/10 000的疊氮鈉防腐,保存于4℃冰箱中。使用時,再以堿-酸-堿處理。





